

朗来科技CFB抑制剂MY008211A片纳入优先审评品种名单并递交新药上市许可申请
-
发布日期2025-10-21
2025年10月15日,武汉朗来科技发展有限公司(以下简称“朗来科技”)自主研发的化学药品1类创新药MY008211A片,结束拟优先审评品种公示期,被国家药品监督管理局药品审评中心(CDE)正式纳入优先审评品种名单,用于治疗既往未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)成人患者。同时,此品种的新药上市许可申请(NDA)已于2025年10月17日被CDE成功受理,进入注册审评阶段。

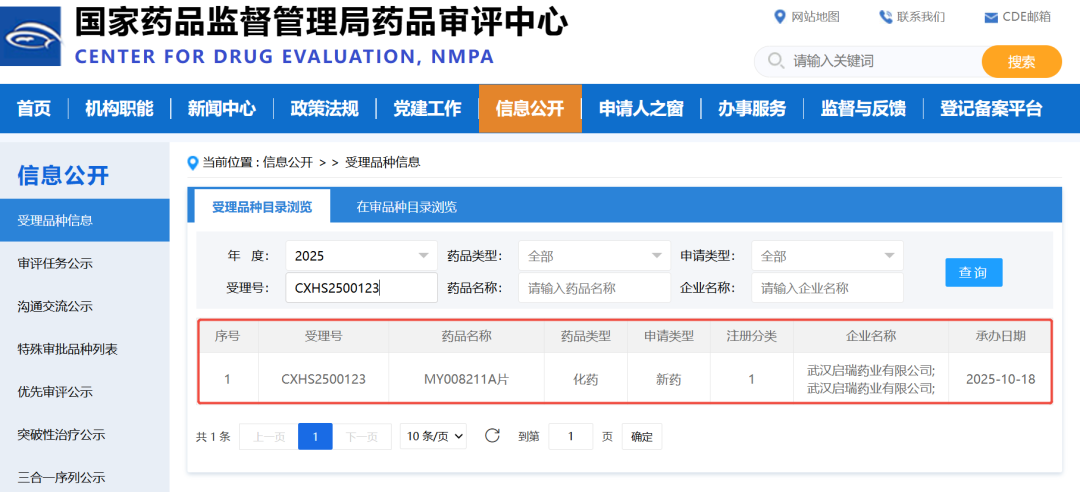
MY008211A是朗来科技自主开发的补体B因子(CFB)抑制剂,其为公司首个进入NDA审评阶段的创新药,也是首个国产自研的CFB抑制剂创新药。
公司于2024年12月在美国血液学会(ASH)正式公布了MY008211A片单药治疗未接受补体抑制剂治疗的PNH患者,一项多中心、开放标签、剂量探索的II期临床研究(NCT06050226)结果,在没有输血的情况下,在第84天,所有剂量组34例受试者(100%)全部达到Hb浓度相较于基线增加≥20g/L的主要终点,且所有患者在MY008211A片治疗后均无需输血。同年12月,MY008211A片还获得了美国食品药品监督管理局(FDA)孤儿药认定,用于治疗PNH。

(MY008211A II期对比诺华LNP023 III期结果)
PHN是一种后天获得性溶血性疾病,是一种慢性、进行性、危及生命、罕见的多系统疾病,2018年被收录进《第一批罕见病目录》,目前尚无国产自研的靶向CFB抑制剂获批上市。
此次通过优先审批程序,意味着 MY008211A的药品上市许可申请审评将进入快车道。CDE将按照优先审评审批工作程序,优先配置审评资源,缩短审评审批周期,同时药品核查中心、药品检验机构和国家药典委员会也将优先进行现场核查、注册检验和核准药品通用名称,根据相关法规要求纳入优先审评审批程序的上市许可申请审评时限将由常规审评的200工作日缩短到130工作日,助力其能更早获批上市,从而惠及更多PNH患者。
















